Elektrokémia
Galváncellák (elemek)
Alappélda:
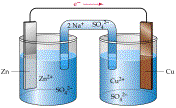
Daniell-elem
A kémiai reakció:
Zn(s)+ Cu2+(aq) ®
Zn2+(aq) + Cu(s)
http://wps.prenhall.com/wps/media/objects/602/616516/Chapter_18.html
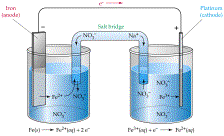
Egy másik példa,
általánosabb redoxi-rendszer:
2Fe 3+ + Fe(s) ® 3Fe2+
A hidrogénelektróddal
szemben mért cellapotenciál definíció szerint az elektródpotenciál:

hidrogénelektród
Galváncellák
(elemek) a gyakorlatban:
Leclanché - (száraz) elem

2005/30
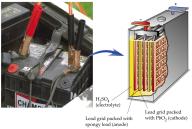
Ólomakkumulátor:
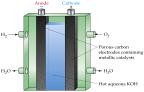
Üzemanyagcellák:
elv ugyanaz, mint szokásos elemeknél,
de folyamatos
adagolás:
www.eere.energy.gov/hydrogenandfuelcells/fuelcells/images/; ps.prenhall.com/wps/media/objects/602/616516/Chapter_18.html

Elektrolízis: wps.prenhall.com/wps/media/objects/602/616516/Chapter_18.html

a. b.


a. Cross-sectional view of a Downs cell for
commercial production of sodium metal by electrolysis of molten sodium
chloride.
b. An
electrolytic cell for production of aluminum by the Hall-Heroult
process. Molten aluminum metal forms at the graphite cathode that lines the cell.
Because molten aluminum is more dense than the Al2O3-Na3AlF6 mixture, it
collects at the bottom of the cell and is drawn off periodically.
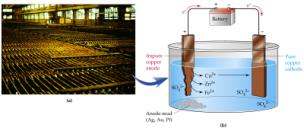
Rézraffinálás: